
217
Ces Urol 2016; 20(3): 214–220
ORIGINÁLNÍ PRÁCE
V rámci hematologické toxicity jsme pozorovali
výskyt anémie stupně I u třech (21,4 %), anémie
stupně II u čtyř (28,6 %) a anémie stupně III u dvou
pacientů (14,3 %). Leukopenie stupně I u dvou (14,3
%) a leukopenie stupně III u jednoho nemocného
(7,1 %). Trombocytopenie stupně I jsme pozorovali
ve třech případech (21,4 %). V rámci nehematolo‑
gické toxicity jsme pozorovali převážně toxicitu
mírného stupně I.–II. Přehled nehematologické
toxicity stupně I a II je uveden v tabulce 2. Nejčastěji
se vyskytovala únava, celkem u sedmi pacientů.
Ze závažných nežádoucích účinků (grade III a IV)
se objevilo srdeční selhání s plicním edémem po
první aplikaci kabazitaxelu u jednoho nemocné‑
ho. Pacient již následně v léčbě kabazitaxelem
nepokračoval. U jednoho pacienta se vyskytla 2x
hematurie s nutností hospitalizace. V cystoskopic‑
kém nálezu nebyl nalezen zdroj krvácení. Hod‑
noty krevního obrazu a koagulace byly v normě.
Po symptomatické terapii se stav upravil a již se
neopakoval v průběhu další léčby kabazitaxelem.
Léčebná odpověď byla hodnocena celkem u 13
pacientů, u jednoho nemocného jsme léčebnou
odpověď nehodnotili z důvodu výše zmíněného
selhání srdce s plicním edémem po první aplikaci
kabazitaxelu. Kompletní remisi onemocnění jsme
nepozorovali ani v jednom případě, parciální remisi
jsme pozorovali u sedmi pacientů (53,8 %), stabili‑
zaci u jednoho nemocného (7,7 %) podle RECIST
1,1 kritérii. Progresi jsme popsali u pěti nemocných
(38,5 %). Dva pacienti progredovali na podkladě
zhoršení klinického stavu se současnou elevací
PSA, tři nemocní měli progresi podle zobrazovacích
vyšetření. K datu hodnocení žilo celkem sedm pa‑
cientů, stejný počet nemocných zemřelo. Medián
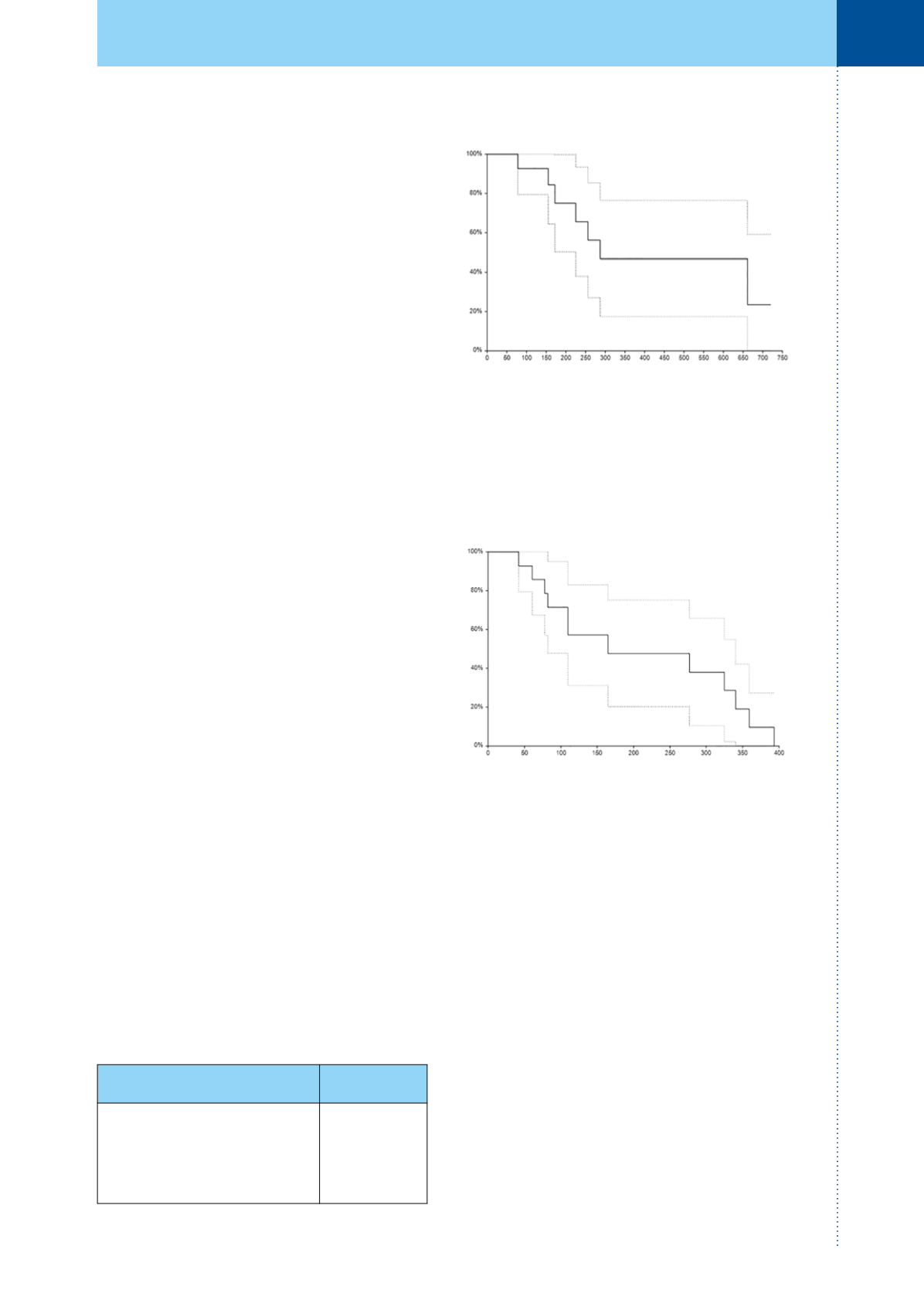
celkového přežití činil 9,6 měsíce (95% CI 7,5–22
měsíců). Dvouleté celkové přežití bylo popsáno
u 23,45 % (95% CI 0–59 %) pacientů (obrázek 1).
U dvou pacientů probíhá terapie kabazitaxelem
doposud. Medián přežití bez známek progrese
činil 5,5 měsíce (95% CI 2,7–10,8 měsíců, obrázek 2).
DISKUZE
Prezentované výsledky hodnotí naše první zkuše‑
nosti s kabazitaxelem v terapii mCRPC po před‑
Tab. 2.
Přehled nehematologické toxicity stupně I–II
Table 2.
Non-hematologic toxicity grade I–II
Přehled nehematologické toxicity
stupně I a II
Počet pacientů
(procento)
Bolesti ve skeletu
Únava
Nechutenství
Zhoršení parestezie
Nevolnost
Zácpa
4 (28.6)
7 (50)
5 (35.7)
1 (7.1)
4 (28.6)
1 (7.1)
Obr. 1.
Celkové přežití pacientů (plná čára). Osa:
x – čas (dny), osa y – relativní přežití (%), přerušovaná
čára – 95% interval spolehlivosti
Fig. 1.
Overall survival (solid line). Axis x – time (days),
axis y – relative survival (%). Dotted line – 95% confi-
dence interval
Obr. 2.
Přežití bez progrese (plná čára). Osa: x – čas
(dny), osa y – relativní přežití (%), přerušovaná čára –
95% interval spolehlivosti.
Fig. 2.
Progression free survival (solid line). Axis x –
time (days), axis y – relative survival (%). Dotted line –
95% confidence interval


















